고대의대 사경하·국립암센터 박종배 교수팀,
악성뇌종양 맞춤치료 가능성 높여
-악성 뇌종양 재발 진화과정 분석해 새로운 치료법 제시
-국제학술지 캔서셀 <Cancer Cell> 게재

(왼쪽부터) 사경하 교수(고려대 의과대학), 박철기 교수(서울대병원), 남도현 교수(삼성서울병원), 박종배 교수(국립암센터)
세계 최초로 교모세포종 암 단백 유전체 분석을 통해 뇌종양 재발 진화과정을 규명하고, 새로운 치료 방안을 제시한 연구 결과가 발표됐다.
고려대학교 의과대학 의료정보학교실 사경하 교수 연구팀과 국립암센터 박종배 교수 연구팀은 악성 뇌종양 중 하나인 교모세포종의 암 단백 유전체 분석을 통해 뇌종양 재발 진화과정을 밝히고, 새로운 치료법을 고안해 냈다.
교모세포종은 치료 방안이 제한적인 악성 뇌종양 중 하나로, 다양한 유전적 변이가 있으며 뇌 신경세포와 유기적으로 연결 가능하다는 특징이 있다. 또한, 초기 치료 후 재발의 빈도가 매우 높으며, 재발 암의 대부분은 방사선 및 항암제 치료에 저항성이 높은 것으로 알려져 있다.
연구팀은 교모세포종 환자 123명의 원발 암과 재발 암에 대한 유전체, 전사체, 단백체 분석을 통해 치료 후 종양세포의 진화과정을 체계적으로 추적 관찰했다. 그 결과, 치료 후 재발 암은 WNT/PCP 신호전달경로*와 BRAF 단백체**의 활성화를 통해 뉴로날(Neuronal) 특성***을 획득했다. 또한, 환자 유래 세포 및 동물모델을 통해 종양 미세환경에 존재하는 정상 신경세포와 시냅스(synapse) 형성이 재발 암의 치료 저항성과 밀접한 관계가 있음을 검증했다.
나아가 BRAF 억제 효과를 가진 표적치료제 베무라페닙(vemurafenib)을 표준항암제인 테모달을 함께 투여했을 때, 재발 종양세포의 뉴로날(Neuronal) 특성이 억제되며 침습 능력이 저해되는 것을 발견하고, 동물모델의 생존 기간이 현저하게 증가하는 것을 확인했다. 이를 통해 재발성 교모세포종의 신규 표적으로 BRAF 단백체 억제를 입증할 수 있었으며, 이를 타깃으로 표적 치료의 새로운 방향성을 제시했다.
사경하 교수는 “기존의 단편적인 유전체 분석만으로는 종양의 진화 패턴을 규명하는데 한계가 있었지만, 이번 연구 결과는 다차원 데이터 분석을 통해 새로운 치료 가능성을 제시할 수 있게 돼 시사점이 크다”고 밝혔다.
박종배 교수는 “유전체부터 단백체 그리고 임상데이터와의 통합을 통해 세계 최초로 신경세포와 뇌종양 세포 간의 네트워크 형성이 뇌종양 재발을 유도함을 규명했다”고 전했다.
이번 연구는 국립암센터 암 단백 유전체 연구사업의 지원으로 진행되었으며, 세계적 국제 저명 학술지인 캔서셀<Cancer Cell> (IF=50.3)에 ‘Integrated proteogenomic characterization of glioblastoma evolution’이라는 제목으로 게재됐다.
*WNT/PCP 신호전달경로: 세포의 증식, 이동 및 분화를 조절하는 신호경로. 암을 포함한 다양한 질병 발생기전과 관련있다.
**BRAF 단백체: Raf kinase 중 하나로 암 관련 중요 신호인 MAP/ERK 신호경로를 활성화해 암세포의 생존, 성장, 분화 등에 영향을 준다.
***뉴로날(Neuronal) 특성: 암세포와 신경세포와의 신경전달물질 상호작용을 통해 암의 성장, 진행 및 전이에 영향을 준다.
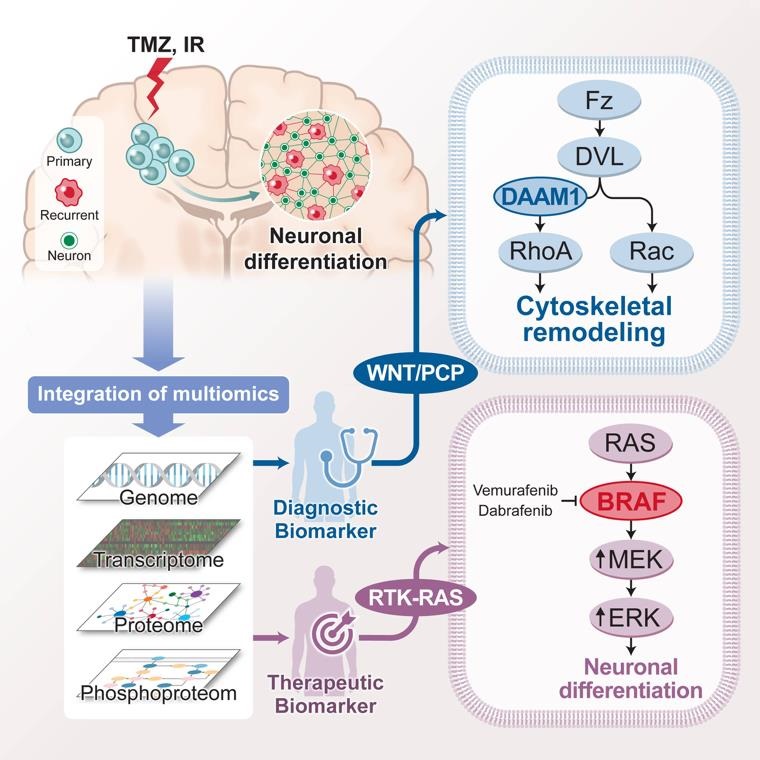
악성 뇌종양 교모세포종의 원발 암-재발 암 암 단백 유전체 분석을 통해 항암표준치료 이후
재발 진화과정을 규명했으며, WNT/PCP의 진단 바이오마커 발굴과 BRAF 단백체에 대한 신규 표적
가능성을 제시했다.
*의료원뉴스:2024-02-06